教学目标
知识目标
通过铁广泛的用途,认识铁与人类生活和社会发展关系紧密;
了解纯铁的物理性质,知道铁的用途在很大程度上决定于铁的性质;
掌握铁的化学性质(与氧气、与盐酸、稀硫酸、硫酸铜溶液),能理解金属活动性的差异,并能应用于对置换反应做简单的判断;
了解锈蚀的条件及防止生锈的简单方法,认识铁资源保护的重要性。
能力目标
通过实验教学,培养学生观察、分析总结、归纳比较的能力;
通过新旧知识的联系,培养学生知识迁移、扩展的能力;
通过探究活动,培养学生查阅资料、分析归纳和研究问题的能力。
情感目标
通过炼铁史的介绍,培养学生的爱国主义思想;
通过性质决定用途,激发学生活用知识为社会造福的兴趣和热情。
教学建议
关于课前探究的教学建议
本节教材主要内容是铁的性质。教材在章前言中,从钢铁的简史和用途出发,在本节以设问方式提出了铁的有哪些性质的问题。这部分的教学建议在课前布置探究课题:“铁的发现和存在、用途和冶炼简史”。这样学生认识会更深刻,对铁性质问题的提出就很自然了。
关于铁生锈的教学建议
关于铁的化学性质是本节的重点,教材中分三点来讲述(铁与氧气、与酸、与盐溶液)。关于铁与氧气的反应,可在复习第一章中学过的氧气与铁的反应的基础上,讨论铁生锈的原理和防锈的方法,关于铁生锈的条件实验可做为家庭探究活动,在一周前安排给学生。并据实验结果,进行分析推理。此处的推理过程和方法与第一章中的关于燃烧条件和灭火原理的推理相似,所以从分析问题的方法上,学生一般不会觉得太困难。最终得出结论,铁生锈是由于铁和氧气、还有水等物质作用发生的复杂的化学反应。
关于铁与酸反应的教学建议
铁与酸的反应可通过复习氢气的制法原理,引出几种不同的金属和酸的反应,如锌、镁、铁与稀硫酸(稀盐酸)反应,可加入铜与酸的反应做对比。加深对铁是一种中等活泼的金属的认识。也要提醒学生注意铁与稀硫酸(稀盐酸)反应时生成+2价铁,当与强氧化性的酸反应时,生成+3价的铁。
关于铁与盐溶液反应的教学建议
与盐溶液的反应,可通过实验观察,提问反应类型(置换反应)。并引出问题,为什么铜不能把铁从溶液中置换出来?从而在氢气制法原理基础上初步接触金属活动性有差异后,进一步引出金属活动性有强弱顺序,为以后酸碱盐的学习做好准备。在这部分教学中不宜做太多的扩展。金属活动性顺序表留在讲酸的性质时再介绍。
关于铁的变价的教学建议
在铁与氧气反应的教学中,教师也可进一步将教学深化,指出铁与氧气反应的产物是四氧化三铁(+2、+3),而铁锈是三氧化二铁(+3),为什么会表现这样的不同。在这儿可结合在第二章中有关元素化学性质与核外电子排布的密切关系入手,铁为26号,最外层有2个电子,处于不稳定结构,易铁电子,当与弱氧化剂作用时,失去最外层的2个电子,显+2价;当与强氧化剂作用时,还要失去次外层的1个电子,显+3价。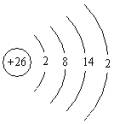
教学设计方案
课题:铁的性质
重点:铁的化学性质
难点:对铁锈蚀条件及其防护措施的初步探究;对铁的化学性质比较活泼的理解。
课时安排:1课时
课前探究:
1. 查阅资料开展“铁的发现、存在和冶炼简史”、“铁的用途”的课题研究。并思考铁为什么会有这么多的用途。
2.查阅资料、社会调查等形式开展关于我国钢铁工业的发展的课题研究。
3.通过一组铁生锈的家庭实验:分析铁在什么条件下最容易生锈,及防止钢铁生锈的措施。(可以把书上的演示实验改进,如加热试管可改为在密闭容器中加入造量干燥剂。也可只做一个生锈的实验,并让学生思考“一个有一半浸在水中的铁钉,哪一部分锈斑最明显,为什么?)从而引导学生在以前研究灭火原理的基础上,运用相似的思维方法,总结分析出铁生锈的原理及防锈的方法。
4.通过观察、做社会调查等形式总结出日常生活及工业生产中用于防锈的方法。
课上教学:
汇报、展示课题1的结果。
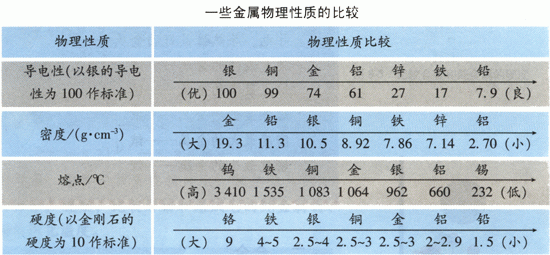
并思考:铁为什么会有这么多的用途?为什么我们用的菜刀、锤子等是用铁制的,而不是用铝制的?看下面的图,讨论。
(菜刀、锤子都应是由硬度大的物质做成,从表中可见,铁的硬度远远大于铝,所以,铁用有以上用途是因其硬度较大。学生也可能进一步提出问题:为什么不用铬呢?这里要讲解,在考虑物质的用途时,性质不是唯一决定因素,还需考虑价格、资源、美观、使用是否便利及是否易于回收和对环境的影响等多种因素。)
同理,铁的其它的用途在很大程度上也是由铁的性质决定。
那么铁到底有哪些重要的性质呢?
板书:一、 铁的物理性质
铁是我们生活中常见的金属,它具有一些多数金属共有的物理性质,比如:能导电,导热,常温下是固体等。此外,铁还有其自己的特性。
生活中见到的铁多不是纯铁,展示纯铁图片:

纯铁具有银白色的金属光泽,质软,有良好的延性和展性。密度是7.86克/厘米3,熔点是1535℃,沸点2750℃。铁是电和热的导体。

铁的用途不仅与物理性质有关,还和化学性质有关。比如铁为什么会生锈?为什么铁制的器皿不能盛装酸溶液?
板书:二、 铁的化学性质
观看录象:(铁生锈:1分29秒)
讨论课前铁生锈的实验:
展示: 一周前开始做的三个铁生锈对比实验结果。
分析思考:
1、三个实验的条件有什么不同?
2、三个实验的结果有什么不同?
3、这说明铁在什么条件下最容易生锈?
4、如何防止铁生锈?
5、举出你所知道的防止铁生锈的例子,它们的原理是什么?
小结:铁生锈是由于铁和氧气、还有水等物质作用发生的复杂的化学反应。
如果铁锈不除去,大家还会看到铁生锈的速度加快。这是因为铁锈很疏松,易吸水而加快生锈。
如何防锈?总结常见防锈方法。(视频)
启发: 铁锈的主要成份是什么?
是氧化铁( ![]() )。在氧气的化学性质学习中我们知道铁在氧气中点燃会发生剧烈的化学反应,生成产物是四氧化三铁。在这两种产物中,铁元素的化合价是不同的,三氧化二铁中显+3,四氧化三铁中铁显+2、+3价。为什么同一元素在不同的物质中会显示不同的化合价,即有这种变价现象呢?
)。在氧气的化学性质学习中我们知道铁在氧气中点燃会发生剧烈的化学反应,生成产物是四氧化三铁。在这两种产物中,铁元素的化合价是不同的,三氧化二铁中显+3,四氧化三铁中铁显+2、+3价。为什么同一元素在不同的物质中会显示不同的化合价,即有这种变价现象呢?
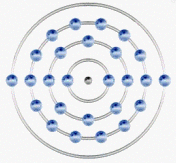
在排外电子排布知识学习中,我们知道元素的化学性质与其原子核外最外层电子排布关系密切。我们来看铁原子的核外电子排布。铁是26号元素:


最外层有两个电子,处于不稳定状态,所以它易与氧化剂作用失去电子,当与弱氧化剂作用时,它只失去最外层2个电子,显+2;当与强氧化剂作用时,它还要失去次外层的1个电子,显+3。
铁是一种化学性质比较活泼的金属,如何去理解?
板书:1.铁与氧气的反应
由氧气的性质知,氧气可以与金属反应。如与镁、与铁。这两种金属与氧气反应有什么不同呢?仔细观察反应的现象,描述其反应现象。(观看镁在空气中燃烧、铁在氧气中燃烧的视频)
小结:镁与氧气更容易反应。
回忆以前学过的知识,金属除了可以和氧气反应外,还可与什么物质反应?(实验室制氢气的原理)
2.铁与酸反应
做铁与酸反应的实验,请学生描述实验现象。(生成物颜色、状态)并据实验现象写出反应方程式。
在氢气的制法中,我们知道某些金属与酸反应放出氢气。我们来做一组对比实验。
金属与酸的反应的实验:锌、镁、铁、铜与稀硫酸(稀盐酸)反应。(操作注意:加酸顺序从铜-铁-锌-镁)
提示学生要注意观察反应进行情况及放氢