colSpan=2>
氧化还原反应、离子反应、化学反应中的能量变化是高中化学的重点内容,在学习中,同学们应熟练掌握以下知识要点。
一、氧化还原反应
1.概念系统
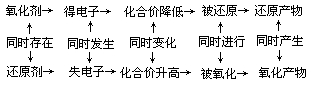
2.基本规律
(1)守恒规律
在任何氧化还原反应中,氧化剂得到的电子数一定等于还原剂失去的电子数,或者说氧化剂化合价降低总数值等于还原剂化合价升高总数值。
(2)反应的基本形式
氧化还原反应一般可以概括成如下形式:

(3)变价规律
如果氧化还原反应发生在不同价态的同一种元素之间,一般说来反应物中高价态变成产物中的较高价态,反应物中的低价态变成产物中的较低价态,即高者仍高,低者仍低,不会出现价态的交叉,因为这样会消耗更多能量。
(4)影响氧化(还原)性的因素
氧化性(或还原性)受氧化剂(或还原剂)的浓度、反应温度、溶液的酸碱性以及催化剂等因素影响。一般地,浓度大、温度高等都有可能使氧化性(或还原性)增强。溶液的酸碱性对物质的氧化性(或还原性)也存在影响。
3.典型题例析
例1 下列反应中,属于非氧化还原反应的是( )
A.3CuS+8HNO3=3Cu(NO3)2+2NO+3S+4H2O B.3Cl2+6KOH=5KCl+KClO3+3H2O
C.3H2O2+2KCrO2+2KOH=2K2CrO4+4H2O D.3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2+2KCl
解析 发生氧化还原反应的标志是化合价的变化。因此,我们可以通过判断是否有化合价变化来判断一个反应是否是氧化还原反应。该题选项为D。
例2 硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,反应中生成的氧化产物和还原产物个数比为( )
A.1∶3 B.2∶3 C.1∶1 D.4∶3
解析 N2是氧化产物,每生成1个N2,要失去6个电子。SO2是还原产物,每生成1个SO2要得到2个电子。要使得失电子守恒,二者个数比为1∶3。选A。
例3 已知:
(1)2FeCl3+2KI===2FeCl2+2KCl+I2
(2)2FeCl2+Cl2===2FeCl3
判断下列物质的氧化能力由大到小的顺序是( )
A.Fe3+>Cl2>I2 B.Cl2>Fe3+>I2 C.I2>Cl2>Fe3+ D.Cl2>I2>Fe3+
解析 由于氧化剂的氧化性强于氧化产物的氧化性。由(1)知氧化性:Fe3+>I2。由(2)知氧化性:Cl2>Fe3+。因此,由不等式的传递性知氧化能力:Cl2>Fe3+>I2。本题选B。
例4 在KClO3+6HCl===KCl+3Cl2+3H2O中,被氧化与被还原的氯原子个数比为( )
A.1∶6 B.6∶1 C.1∶5 D.5∶1
解析 KClO3中的氯由+5价被还原成0价,HCl的氯部分被氧化成0价,为了使得失电子数相等,被氧化的氯和被还原的氯原子个数比应为5∶1,选D。
二、离子反应
1.概念系统

(2)离子反应是指有离子参加的反应,其实质是通过反应使溶液中某些离子的数目发生明显的减少。生成沉淀、气体、难电离物质或发生电子转移等都可以使溶液中的离子数目发生明显减少。离子方程式不仅能表示一定物质间的某个反应,而且还能表示所有的同一类型的离子反应。
2.基本规律
(1)溶液的导电性受溶液、导电微粒、电极、电压、电极距离等多种因素影响。在其它条件相同时,单位体积中自由移动离子数目多,溶液的导电性也就强。但要注意H+和OH-有着与其它离子不同的导电机制。
(2)电解质和非电解质的区分是看它们在受热或水分子作用下能否电离。强电解质和弱电解质是以能否完全电离为标准来区分的,与溶液的导电性以及物质的溶解性无必然联系。
(3)NH3、CO2、SO2的水溶液虽然能导电,但它们不是电解质,因为导电的原因是这些物质与水作用生成的新物质电离所致。
(4)强酸、强碱、一些盐类在离子方程式中应写成离子形式,其它物质如单质、氧化物、难溶物质、挥发性物质、弱电解质、非电解质都应该写成分子形式。微溶物视情况而定。
(5)固态条件下的离子反应不写离子方程式。
3.典型题例析
例5 下列物质在水中或熔融状态下都能导电的是( )
A.HCl B.NaHCO3 C.Na2O D.NaOH
解析 液态的HCl不电离,NaHCO3加热时分解,Na2O在水中与水作用生成NaOH,因此本题选D。
例6 下列离子方程式中,正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+=Cu2+ + H2↑
B.硫酸钠溶液与氯化钡溶液反应:
C.盐酸滴在石灰石上:
D.氯化铜与烧碱溶液混合:Cu2++2OH-=Cu(OH)2↓
解析 一个正确的离子方程式应该正确地反映事实,拆分分子式正确、配平,同时也要符合反应时的数量关系。该题正确选项为B、D。
例7 下列各组中的离子,能在溶液中大量共存的是( )
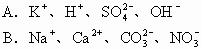
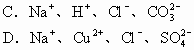
解析 能在溶液中大量共存就是相互之间不反应。因此,生成沉淀、气体、弱电解质或发生电子转移都是离子不能大量共存的原因。此外,有色离子也不能在无色溶液中大量存在。
三、化学反应中的能量变化
1.概念系统


2.基本规律
(1)一个反应是吸热的还是放热的,只与反应物与生成物有关,与反应途径无关。例如,Ba(OH)2·8H2O与NH4Cl反应吸热,但Ba(OH)2溶液与NH4Cl溶液反应却是放热的。
(2)物质的颗粒越小,其表面积越大,与空气接触越充分。